生物负荷测试
生物负荷:制药与医材安全的关键角色
生物负荷 (Bioburden),也称为生菌数或负荷菌,通常指的是产品、原材料或表面上存在的活体微生物总数量 (如细菌、真菌、病毒等)。它能有效评估和控制产品的微生物含量,不仅是确保产品质量的基石,更是保障患者与消费者安全的关键。
为什么生物负荷测试很重要?
生物负荷测试 (Bioburden testing),又称为生菌数测试 (total viable count, TVC) 或微生物限度(量)测试 (microbial limit testing),是制药与医疗产业中关键的质量控制过程 (quality control, QC),用于侦测及量化产品在灭菌前的活体微生物含量,能够反映原料质量、生产流程洁净度、污染控制状况,并作为制定灭菌参数及验证灭菌效果的依据。
全球主要法规机构,如美国食品药品监督管理局 (FDA) 和国际标准化组织 (ISO),都明确要求需执行生物负荷测试。例如:
· ISO 11737-1:被广泛用作医疗器材的生物负荷测试标准,并被欧盟医疗器材法规 (EU MDR) 和 美国食品药物管理局 (FDA 510 (k)) 认可为共识标准。
· 美国药典USP<61>,<62>,<1115>:涵盖非无菌产品 (nonsterile products) 微生物限度与控制策略。
生物负荷测试被广泛应用于医疗器材、制药、生物制剂和食品与保健品等高风险产业,做为确保产品安全与法规合规的关键步骤。
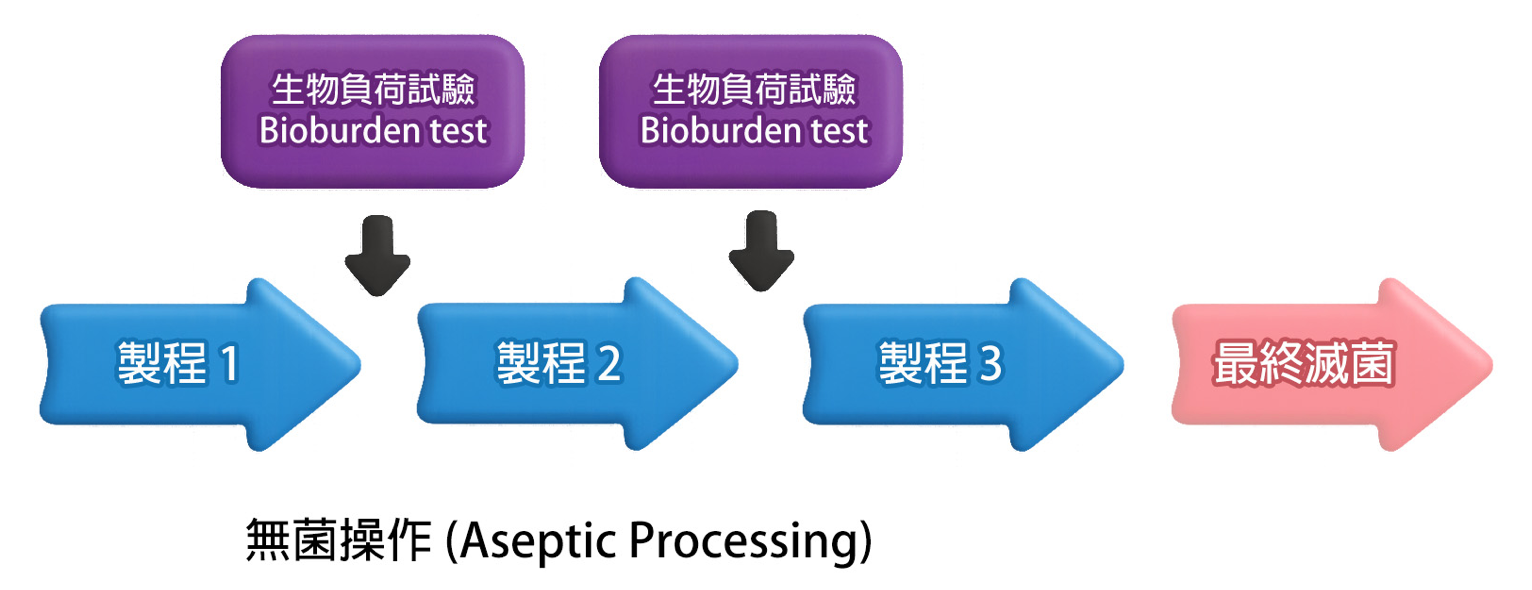
生物负荷测试一般在最终灭菌程序 (terminal sterilization) 前、或在无菌制程 (aseptic processing) 中「无菌过滤或充填步骤」前进行。测试结果所反映的微生物含量,即为整体制程洁净度的指标。因此,生物负荷测试被视为制程洁净验证与污染控制策略中的关键步骤,其代表意义如下:
· 灭菌策略设定:
微生物的数量及类型会直接影响最终灭菌的有效性。如果生物负荷过高,即使按照标准流程进行灭菌,也可能无法wanquan杀死所有微生物。因此,生物负荷水平越低,产品越容易灭菌。
· 质量管理及控制:
透过定期监测生物负荷水平能确认制程洁净度是否稳定、指出制程中的破口,并且使最终产品的微生物含量符合规范范围内。
· 风险评估:
生物负荷有助于评估产品对患者或消费者的潜在感染风险。特别是医疗器材,若无法有效控制生物负荷,可能导致医疗相关感染 (Healthcare-associated infections, HAIs)。其特性分析有助于了解内毒素 (endotoxin) 的存在,即使灭菌成功,部份细菌仍会释出内毒素,对患者健康造成潜在风险。
· 法规要求:
许多国家和地区的法规,例如 ISO 11737-1,都要求医疗器材和药品制造商定期进行生物负荷测试,以符合相关的质量和安全标准。
生物负荷的来源是什么? 如何控制负荷菌 (bioburden control) ?
微生物 (microbial) 可透过多种管道进入产品或原料中。从原物料、人员、设备,乃至整个制造过程,都必须透过严格监控,使灭菌程序发挥最大功效,制成使用安全无虞的产品。
常见的生物负荷来源及控制方式如下表所示:
| 来源 | 控制方式 |
| 原材料 | 对原材料进行微生物检测和控制 |
| 制造环境 | 维持洁净的生产环境,例如:使用无尘室、空气过滤系统等 |
| 人员 | 穿着无菌服装,并遵守严格的卫生程序 |
| 设备与工具 | 定期对设备和工作表面进行cedi清洁和消毒 |
| 制造过程 | 遵守无菌操作规范,并选择产品合适的灭菌方法 |
常见的生物负荷试验流程及方法?
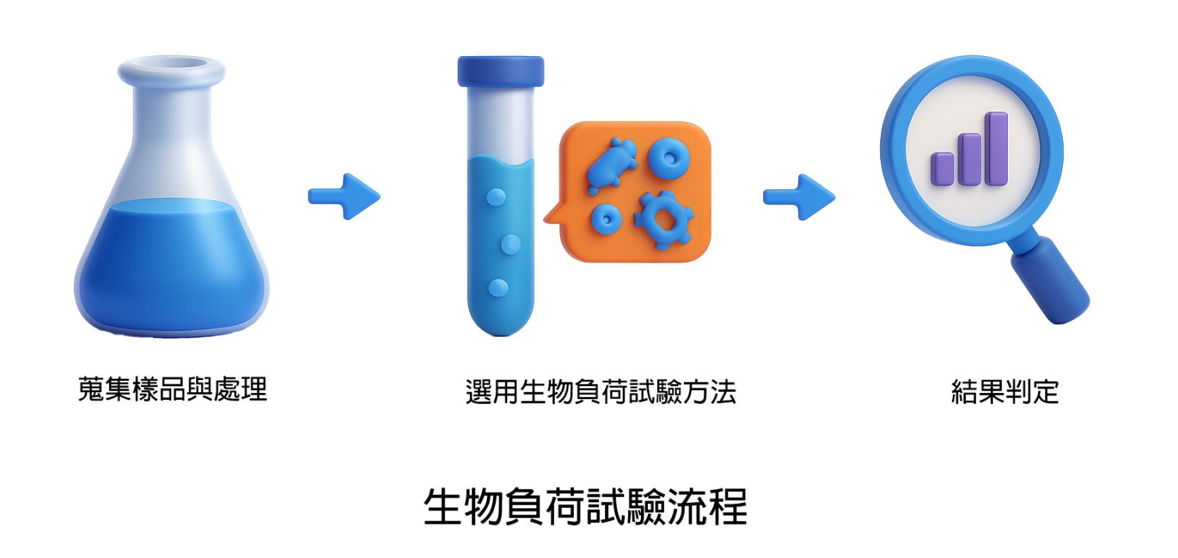
1. 收集样品与处理:
依检品之物理特性选用适用的前处理方式,取得待测检液。若无适用方法,则应建立适当之替代序程。
| 样品 | 检液配制 | |
| 水溶性检品 | 以适当缓冲液或培养基溶解 | |
| 非油性不溶于水检品 | 以适当缓冲液或培养基溶解,可添加界面活性剂 | |
| 油性检品 | 检品溶解于适当酯类溶剂,再以预热稀释液稀释检品 | |
| 喷雾式液体/固体检品 | 将容器中检品移入微孔滤膜过滤装置 | |
| 贴片检品 | 具有黏性之面朝上放在无菌容器中,覆盖无菌多孔材料,再将贴布移入适当稀释液中,振荡至少30分钟 |
2. 选择适合的测试方法:
为了量化负荷菌,目前主流有四种定量分析方法,包含微孔滤膜过滤法 (Membrane Filtration Method)、倾注培养法 (又称混合稀释法,Pour Plate Method)、表面涂布法 (又称涂抹法,Spread Plate Method) 以及多重试管法 (又称最确数法,Most-Probable-Number, MPN),请根据检液特性选用适合的测试方法:
| 微孔滤膜过滤法(Membrane Filtration Method) | 培养皿法 / 平板法 (Plate Count Methods) | 多重试管法 (Most-Probable-Number, MPN) | ||
| 倾注平板法 (Pour Plate Method) | 表面涂布法 (Spread Plate Method) | |||
| 原理 | 检液以 0.45 μm 滤膜过滤后,将滤纸置于培养基上,进行培养 | 将检液与未凝固之培养基一起倒入培养皿中,进行培养 | 将检液涂抹于培养基中,进行培养 | 将检液进行至少3个连续10倍之序列稀释,进行培养 |
| 适合样品 | 可过滤之大量液态、生物负荷较低的样品 | 无法过滤之样品,如凝胶、黏胶物质等 | 无法过滤之少量样品 | 生物负荷极低的产品 |
| 适用热敏感物质 | 是 | 否 | 是 | 是 |
| 准确度 | 高 | 高 | 高 | 低 |
| 培养时间 | 约 5~7 天 | 约 3~7 天 | 约 3~7 天 | 约 3~7 天 |
| 结果单位 | 菌落形成单位 (CFU) | 菌落形成单位 (CFU) | 菌落形成单位 (CFU) | 依最确数表推估 |
*
一般认为多重试管法 (MPN) 是最不准确的方法,因此本法仅于无其他方法适用时才予选用。
3. 结果判定:
根据试验结果判定产品是否符合法规标准,或用以评估最终灭菌所需之水平。
其中,微孔滤膜过滤法不仅是最常见的生物负荷检测方法之一,也可以移除检体中的干扰物质。若待测样品中含有抑制微生物的生长与繁殖的成分,如抗菌剂 (antimicrobial agent) 或其他具抑菌活性 (antibacterial activity) 的成分,可能会导致检测结果出现伪阴性 (即样品中实际存在微生物,但因生长受抑制而未被检出)。因此,当检体特性适合以微孔滤膜过滤法操作时,该方法常被视为进行生物负荷试验的shouxuan技术。其方法是将检液通过 0.45 μm 的滤膜,捕捉大于孔径的微生物,再将滤膜转置至适当培养基中培养,观察菌落生长情形。
为加速过滤流程,洛科/ROCKER 提供多款真空过滤系统 (vacuum filtration system),皆兼容 0.45 μm 滤膜,并可搭配不锈钢、塑料材质漏斗,专为生物负荷测试设计。
生物负荷试验最佳shouxuan:多连真空过滤系列,提升通量及效率
| 洛科 Multi Vac 301 – MB – A 多连真空过滤系统 | 洛科 SolarVac 1201 – MB – T 旋转多连真空过滤系统 |
|
|
| · 直接排水设计、省空间、省时间 · 极速拆装设计,SS316 不锈钢制作 · zhuan利旋卡紧扣设计 · 可选择三连、六连座 | · 旋转盘设计方便操作,避免交叉污染 · 大容量 PP 真空瓶含可快速直接排废液 · SS316 及硅胶材质,可高温高压灭菌 · 可选择六连、十二连座 |
「生物负荷试验 」与「 无菌试验 」的差异?
生物负荷试验 (bioburden testing) 与无菌试验 (sterility testing) 是医疗器材和制药行业中,确保产品无菌性的两个不同但相关的测试,其目的、执行时机和方法有所不同。
| 生物负荷试验 (bioburden testing) | 无菌试验 (sterility testing) | |
| 目的 | 量化并监控制程中的活体微生物总量 | 确定最终产品的无菌性 |
| 执行时机 | 产品最终灭菌前的制程中设立检查点 | 产品经最终灭菌后 |
| 操作环境 | 一般层流柜 (laminar flow) | 无菌检测隔离器 (Isolator) |
| 洁净度 Class 100 (a ji) | ||
| 测试方法 | 微孔滤膜过滤法 倾注平板法 表面涂布法 多重试管法 | 微孔滤膜过滤法 直接接种法 |
| 测试对象 | 未经灭菌前的产品 非要求无菌之产品 | 最终产品 要求无菌之产品 |
| 样器类型 | 药品 (固体及液体) | 药品 (固体及液体) 医疗器材 |
| 测试结果 | CFU 数值 (微生物含量) | 是/否无菌 |
| 结果应用 | 评估灭菌剂量和参数;微生物监测和趋势分析、制程风险评估 | 验证产品无菌性,最终放行产品的依据之一 |
| 标准依据 | ISO 11737-1 USP<61> USP<62> | ISO 11737-2 USP<71> |
| 中华药典 | (7007.1) 微生物计数法 (7007.2) 特定微生物检验法 | (7001) 无菌试验法 |
总体而言,生物负荷试验是预防性和制程控制的工具,用以了解和管理产品在灭菌前的微生物含量信息;而无菌试验则是验证性和质量保证的工具,目的为确认最终产品在经过灭菌处理后是否符合无菌要求
应用
1、 医疗器材产业:如手术刀片、导管、缝线、人工关节等
2、制药产业:无菌注射剂、药品原料、生物制剂 (疫苗、抗体、细胞治疗产品) 等
3、食品产业:食品厂环境监控、水样监测等
4、化妆品:产品原料
更多详细 厦门洛肯仪器有限公司